

喜讯|精准医研院青年研究员王华伟开发新型仿生药物递送系统
发布日期:2021-12-24 11:34:32 作者: 来源:
浏览次数:15293
一、科研速递
药物的靶向递送可以提高药物的治疗效能,降低药物的毒性,是现代生物医学发展的一个重要研究方向。如同北斗导航系统一样,生物体内也有一套精密的归巢机制(homing mechanism)来引导特定的细胞,例如淋巴细胞和间充质干细胞,使之能够高效特异地迁移到目标疾病区域【1】。这一归巢机制是由多个分子协同调控的多步骤复杂过程,主要包括:
1.迁移细胞与血管内皮细胞上的细胞黏附因子(例如选择素,selectins)的相互作用;
2.迁移细胞上的整合素分子(integrins)被目标组织特异的趋化因子(chemokines)或细胞因子(cytokine)激活,并与内皮细胞形成牢固黏附(firm adhesion);
3.在趋化因子的浓度梯度引导下,迁移细胞进行跨内皮层迁移(transendothelial migration, TEM),并且在组织内向特定的目标区域进行主动的趋化运动(chemotaxis)。
利用生物体内生的归巢机制来设计并改造基于生物细胞的仿生药物递送系统(Bioinspired natural delivery systems) 是一个极富吸引力的研究方向【2】。其中,间充质干细胞因为其特有的低免疫原性,较强的归巢能力和旁分泌能力获得了人们的广泛关注。然而,近期的临床试验结果显示,以间充质干细胞为代表的完整细胞载体并不能非常稳定有效地归巢到目标组织中,因而在不同的病人中其疗效往往相去甚远【3】。这主要是因为原代细胞载体的供体不同,来源组织不同,培养方式与时间不同等等造成的细胞异质性(heterogeneity)【3】。利用基因工程的方法可以让趋化因子受体等归巢调控分子在细胞载体上稳定高效的表达,从而有效地改善细胞载体的归巢能力。然而,这些方法却也往往同时引入了安全性的问题:基因改造可能会破坏细胞的基因组稳定性,而基因改造后的细胞载体也可能会在病人体内不受控制的分化增殖,甚至有可能会引发癌症等严重的后果【4】。
为了解决这些问题,近年来一系列新的仿生药物递送载体被设计并发展了起来,其中包括,红细胞递送载体,外泌体递送载体,生物膜包裹的纳米颗粒递送载体等等。这些递送载体的共同特点是它们都具有与细胞类似的生物膜结构,具有一定的靶向递送能力,不会引入外源的基因组DNA并在生物体内易于降解从而减少了安全风险。然而,这些新的仿生药物递送载体通常只具有有限的生物膜蛋白相互作用能力,并不具有在归巢机制中至关重要的趋化运动能力以及整合素受控激活并与血管内皮细胞形成牢固黏附的能力。这就使得这些载体虽然相较于完整细胞载体更加安全,却并不能有效地利用归巢机制【5】。因此,如何在保证安全性的前提下,使仿生药物递送载体能够充分利用生物内生的归巢机制以获得高效特异的靶向药物递送,是一个亟待解决的科学问题。
二、喜讯
2021年12月20日,王华伟博士及其同事在Nature Biomedical Engineering上在线发表长文Genetically engineered and enucleated human mesenchymal stromal cells for the targeted delivery of therapeutics to diseased tissue,并首次提出可以用生物工程的方法将去核细胞改造为兼具高效与安全的新型仿生药物递送载体。

与大多数人的直观印象不同,早在上世纪70年代末,人们就已发现将真核细胞的细胞核通过超高速离心的方法去除之后,剩余的胞质体(Cytoplast)并不会马上的死亡。在本研究中,研究人员发现,将间充质干细胞的细胞核去除之后,剩余的胞质体在合适的条件下可以持续存活3天左右。这些胞质体具有完整的质膜结构,其膜蛋白的表达和膜表面zeta电位都与完整的细胞类似。尤为引人注意的是,将体外人工合成的mRNA导入到这些胞质体后,它们可以正常的合成包括绿色荧光蛋白(GFP),Gaussa 荧光素酶(Gluc),细胞因子IL-10在内的多种蛋白。其中Gluc和IL-10还可以被正常的分泌到胞外并具有完整的生物学活性。这些结果证明间充质干细胞的胞质体具有完整的蛋白质翻译、合成、修饰、以及分泌的功能,并提示其保有的高尔基体,核糖体,线粒体,及内质网等重要的亚细胞器仍然可以正常地协同工作。通过体外实验,研究人员进一步地发现经过生物工程改造的胞质体,1,可以与细胞黏附因子选择素特异地相互作用;2,通过质膜上复杂的信号传递,其膜上的整合素可以被特定的趋化因子激活,并与内皮细胞上的整合素配体高效地结合;3,根据其质膜上表达的趋化因子受体,这些胞质体还可以向相对应的趋化因子浓度梯度进行主动的趋化运动。这些体外实验的结果提示这些间充质干细胞的胞质体有可能在生物体内具有与完整细胞类似的归巢能力,有潜力实现精准高效地靶向递送。为了与其他的去核细胞加以区分,这种通过物理方法制备的专门用于药物递送的胞质体被命名为了胞质载体(Cargocyte)(图1)。
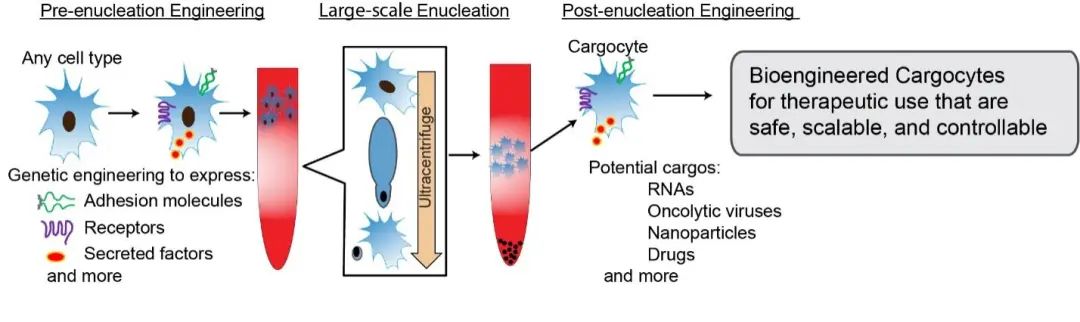
图1:通过生物工程的方法将去核细胞改造为高效特异的递送载体
接下来,研究人员在一个精巧的动物疾病模型中检测了胞质载体在体内的归巢与递送能力。细菌来源的脂多糖(Lipopolysaccharide,LPS)可以在小鼠一侧的耳部(例如右耳)引发局部的急性炎症反应,而另一侧(例如左耳)却并不会受到影响。利用这一模型,研究人员可以在同一个实验动物中比较静脉注射的胞质载体迁移到炎症组织与相对应的正常组织的数量,从而检测胞质载体针对这一炎症组织的归巢能力。根据在LPS诱导的炎症组织中高表达的趋化因子谱及细胞黏附因子谱(例如Ccl2, SDF-1a,P-selectin, 以及 E-selectin等),研究人员设计改造了胞质载体,使之稳定地高表达相对应的趋化因子受体Cxcr4,Ccr2, 及选择素配体Psgl-1。通过活细胞荧光染色标记,生物发光成像,以及免疫荧光组织化学染色等多种方法,研究人员发现改造后的胞质载体高效特异地迁移到了有炎症的右耳,而几乎不会迁移到没有炎症的左耳。进一步的研究发现改造后的胞质载体在导入外源合成的细胞因子IL-10的mRNA后,可以在小鼠的炎症组织特异高效地表达递送具有生物活性的IL-10蛋白,并且有效地抑制炎症反应以使组织尽快恢复正常。而在另一个小鼠急性胰腺炎模型中,改造后的胞质载体同样可以特异地迁移到疾病部位,高效地递送治疗蛋白并且显著地改善病情。
这些实验结果在两个独立的动物疾病模型中首次证明了胞质载体在生物体内的归巢与递送能力,是重要的概念验证型(proof-of-concept)的工作。如何针对特定的疾病来进行胞质载体的设计与改造将是接下来的研究重点。
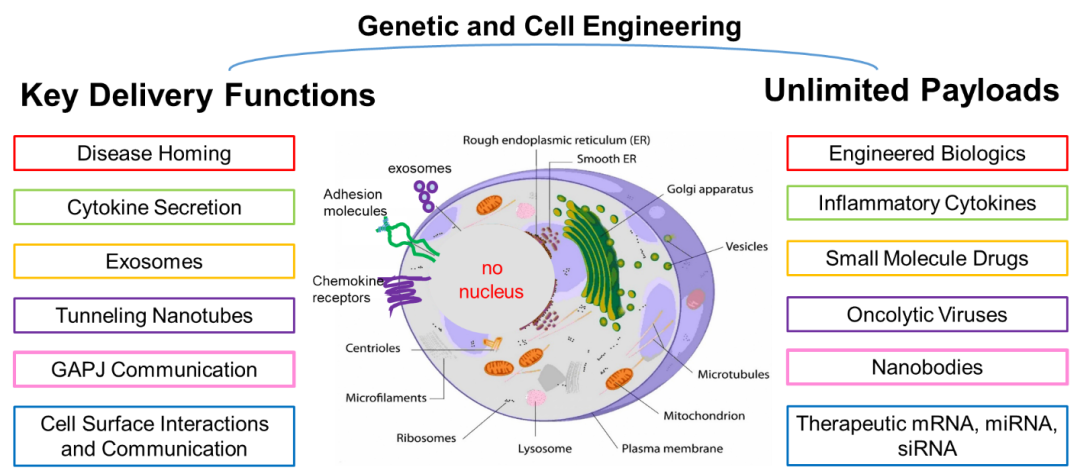
图2:胞质载体是一种可以个性化定制的多功能仿生递送载体。
综上所述,胞质载体是一种介于完整细胞与外泌体之间的新型仿生递送载体。它有与外泌体类似的安全性,同时也有与完整细胞类似的在生物体内的归巢与递送能力。胞质载体具有高生物相容性,低免疫原性,不会导入外源的基因组DNA,没有在体内分化增殖的能力,因此具有高度的临床安全性。胞质载体可以从包括间充质干细胞在内的多种细胞中获得,可以针对特定的疾病组织用多种生物工程的方法来编辑改造,也可以用来递送包括细胞因子,纳米抗体,溶瘤病毒在内的多种生物或化学药物,具有广阔的应用前景(图2)。
王华伟博士和博士生Christina Alarcon(现为Takeda California 公司高级病理科学家)为该论文共同第一作者。加州大学圣地亚哥分校医学院Richard Klemke教授为该论文通讯作者。王华伟博士和Richard Klemke教授是相关核心专利(US patent number: US10,927,349 B2; PCT number: WO 2019/032628 A1.)的共同发明人。该专利已于2021年2月获美国国家商标专利局的批准。
三、人物介绍
中科院遗传与发育生物学研究所博士,加州大学圣地亚哥分校病理系博士后,助理研究科学家,于2021年全职加入粤港澳大湾区精准医学研究院(广州)并担任青年研究员,组建精准递送与免疫治疗实验室(Laboratory of Precision Delivery and Immunotherapy)。
四、课题组介绍

课题组长王华伟在发育生物学,癌症生物学,细胞工程与肿瘤免疫治疗等方面积累了丰富的研究经验,曾在Nature Biomedical Engineering, Cancer Research, Cell Discovery, PNAS, Nature Communication等重要学术期刊发表过多篇学术论文,申请了多项美国与中国专利并且成功获得了授权与转化。课题组将主要聚焦于基于细胞的仿生递送载体的研究,与复旦大学林鑫华教授团队紧密合作,利用复旦大学遗传工程国家重点实验室的多个平台例如类器官研究平台,针对重大人类疾病例如扩散型恶性肿瘤,开发新型的精准递送载体以及免疫疗法,全力助力精准医学。
目前,王华伟博士已于今年11月全职加入复旦大学粤港澳大湾区精准医学研究院(广州),任职细胞治疗与免疫治疗中心课题组长。课题组将主要聚焦于基于细胞的仿生递送载体的研究,并与复旦大学林鑫华教授团队紧密合作,利用复旦大学遗传工程国家重点实验室的多个平台例如类器官研究平台,针对重大人类疾病例如扩散型恶性肿瘤,开发新型的精准递送载体以及组合型免疫疗法。
五、加入我们
课题组长期招聘博士后,科研助理和实习生。研究院科研条件好,待遇优厚,欢迎有兴趣的同学投递简历。
简历投递(有意者请将个人简历等材料发至):hr@ipm-gba.org.cn(付老师),邮件标题请注明“应聘精准医研院-王华伟课题组-博士后-本人姓名”,招聘详情可扫描下方二维码详细了解:

参考文献:
1. Ullah, M., Liu, D.D. & Thakor, A.S. Mesenchymal Stromal Cell Homing: Mechanisms and Strategies for Improvement. iScience 15, 421-438 (2019).
2. Yoo, J.W., Irvine, D.J., Discher, D.E. & Mitragotri, S. Bio-inspired, bioengineered and biomimetic drug delivery carriers. Nat Rev Drug Discov 10, 521-535 (2011).
3. Galipeau, J. & Sensebe, L. Mesenchymal Stromal Cells: Clinical Challenges and Therapeutic Opportunities. Cell Stem Cell 22, 824-833 (2018).
4. Marks, P.W., Witten, C.M. & Califf, R.M. Clarifying Stem-Cell Therapy's Benefits and Risks. N Engl J Med 376, 1007-1009 (2017).
5. Thanuja, M.Y., Anupama, C. & Ranganath, S.H. Bioengineered cellular and cell membrane-derived vehicles for actively targeted drug delivery: So near and yet so far. Adv Drug Deliv Rev 132, 57-80 (2018).
转载说明:
本文转载自NBE | 王华伟博士等开发一种新型的基于生物细胞的仿生药物递送系统 (qq.com),责编:兮,制版人:十一。
原文链接:https://www.nature.com/articles/s41551-021-00815-9
粤港澳大湾区精准医学研究院
GREATER BAY AREA INSTITUTE OF PRECISION MEDICINE
 公众号二维码
公众号二维码
版权所有© 粤港澳大湾区精准医学研究院 粤ICP备2021038868号 粤公网安备 44011502000710号
