

Life Med | 倪挺/顾正龙揭示PTBP1可调控NDUFV3外显子跳跃影响细胞衰老及线粒体功能
发布日期:2024-09-06 12:20:08 作者: 来源:
浏览次数:45279
衰老是导致生殖之后生理机能衰退,进而诱发多种重大慢性疾病及个体非意外死亡的最大风险因素。细胞是生命活动的基本单元,而线粒体则是人类等真核生物细胞的能量供应及代谢核心,是维持人体等“负熵”体系复杂有序性的关键,故而细胞衰老及线粒体功能障碍是衰老的重要特征及诱因之一。因此探究导致细胞衰老和相关线粒体功能障碍的机制(尤其是两者的共性机制),对揭示衰老及相关疾病的发生发展机制、并开发对应的检测及干预措施提供重要启发。多种内外源因素皆可促发细胞衰老进程,包括复制压力、端粒缩短、氧化应激、癌基因激活、基因表达稳态失衡等。按诱因不同,细胞衰老可分为复制性细胞衰老及诱导型细胞早衰。在导致衰老相关线粒体功能障碍的众多因素中,线粒体DNA突变积累及线粒体定位蛋白基因的表达改变则得到了较多关注。
可变剪接作为真核生物调控基因表达、丰富转录组多样性的核心过程之一,在多种生物学过程中存在显著改变并发挥着重要作用。并且,多个线粒体相关基因(如线粒体复合体Ⅰ亚基基因NDUFV3等)存在着不同类型的转录本及蛋白异构体,且这些异构体的使用比例具有显著的组织及细胞类型特异性,预示这些基因的可变剪接改变及相应的上游剪接调控因子的表达改变对于调控线粒体、细胞及组织器官的功能亦发挥着重要作用。多项研究已经揭示在细胞衰老过程中存在着显著的可变剪接改变,如倪挺团队等前期的部分研究已证明其中的选择性多聚腺苷酸化(APA)、内含子保留(IR)改变可促进细胞衰老进程。不过,作为动物中最主要的可变剪接类型,外显子跳跃在细胞衰老过程中的变化规律、上下游调控机制及功能仍未充分揭示。同时,在细胞衰老过程中,可变剪接的改变是否可作为导致衰老相关线粒体功能障碍的重要原因亦鲜有报道。因此,以可变剪接(尤其是出现频率最高的外显子跳跃事件)为重点,探究细胞衰老及相关的线粒体功能障碍的共性机制,将有助于发现调控细胞衰老、线粒体功能及其它生物学过程的新机制。

近日,复旦大学生命科学学院倪挺课题组、粤港澳大湾区精准医学研究院顾正龙课题组在Life Medicine杂志在线发表了题为Cellular senescence induced by down-regulation of PTBP1 correlates with exon skipping of mitochondrial related gene NDUFV3的研究论文,基于二代转录组测序(RNA-seq)、全长三代转录组测序(ONT)、组学大数据分析等技术方法,研究团队绘制了人类包皮皮肤成纤维细胞(HFF)复制性衰老过程中外显子跳跃的动态变化图谱,并发现剪接因子PTBP1的表达下调是导致多个细胞衰老相关外显子跳跃改变事件(如NDUFV3的第三个外显子跳跃增加)的核心原因之一;同时功能研究发现PTBP1的表达下调可导致细胞衰老(如SA-β-Gal活性增加、细胞增殖阻滞等)及相关线粒体功能障碍(如线粒体膜电位下降、氧化应激上升及ATP产量下降等),而部分原因则是由于NDUFV3的外显子跳跃增加所导致;而进一步的数据分析揭示PTBP1与NDUFV3外显子跳跃的机制及功能调控关系在多种细胞衰老体系及癌症中皆具有广泛的普适性。
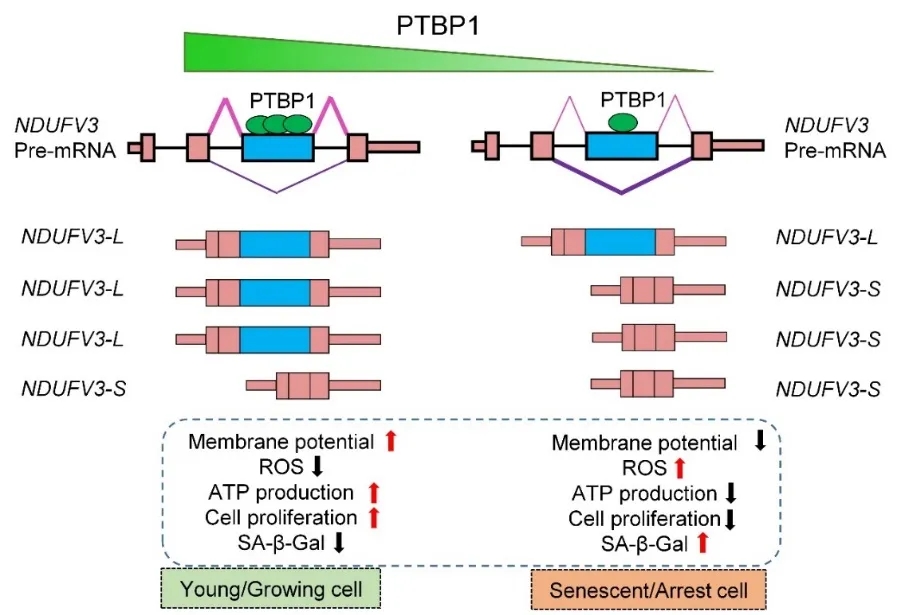
图1 PTBP1调控NDUFV3外显子跳跃并影响细胞衰老及线粒体功能的模式图
首先,研究团队通过对已发表的HFF复制性细胞衰老前后的RNA-seq数据进行重分析,发现伴随着HFF复制性细胞衰老过程存在着明显的可变剪接改变,其中外显子跳跃是最多的类型(见原文)。具体示例包括NDUFV3第3个外显子的跳跃增加(外显子跳跃转录本NDUFV3_S/外显子包含转录本NDUFV3_L的相对使用比例上升),及PRMT2第2个外显子的跳跃减少(PRMT2_S/PRMT2_L的相对比例下降)。
之后,通过对POSTAR 3.0数据库收录的数百个RNA结合蛋白(RBP)的CLIP-seq及eCLIP-seq数据进行整合分析,研究团队发现PTBP1是最显著结合于差异外显子区域的剪接因子,且PTBP1在HFF复制性细胞衰老过程中显著下调,由此研究团队猜测PTBP1的表达下调可能是导致细胞衰老相关外显子跳跃改变的潜在原因。为验证此猜想,研究团队产生了在HFF细胞中敲低PTBP1前后的常规转录组(RNA-seq)及定量全长转录组(ONT)数据,进一步分析发现剪接因子PTBP1的表达下调不仅导致众多的基因表达改变,亦导致大量基因的外显子跳跃改变(1304个显著差异的外显子跳跃事件),且基因表达及外显子跳跃变化图谱皆与HFF的复制性细胞衰老过程具有相似性,由此表明PTBP1的表达下调是导致细胞衰老过程中众多外显子跳跃事件发生的重要贡献者之一(见原文)。值得注意的是,与复制性细胞衰老过程类似,敲低PTBP1亦可导致NDUFV3的第3个外显子跳跃程度明显增加,且eCLIP-seq数据显示PTBP1可直接结合于NDUFV3基因pre-mRNA的3号外显子对应区域,提示PTBP1可直接调控NDUFV3基因的外显子跳跃。
由于PTBP1的表达下调导致了大量基因的表达水平(如CDKN1A、CDKN2A等细胞衰老相关基因)及外显子跳跃(NDUFV3等线粒体相关基因)的改变,研究团队推测PTBP1的表达下调不仅可以导致明显的细胞衰老经典表型,同时亦可以导致显明显的衰老相关线粒体功能障碍特征。为了验证该推论,研究团队对敲低PTBP1前后的HFF及HEK293T细胞进行了相关功能检测,发现敲低PTBP1不仅可以导致明显的细胞衰老表型(SA-β-gal染色阳性细胞比例增加、CDKN2A等细胞周期抑制因子表达上调、细胞增殖抑制等),还可导致明显的衰老相关线粒体功能障碍特征(线粒体膜电位下降、ATP产量下降、氧化应激上升等)。
由于线粒体功能稳态维持对于细胞及个体的年轻健康至关重要,而PTBP1表达下调可直接导致NDUFV3的外显子跳跃增加。那么,NDUFV3外显子跳跃的增加是否也会导致细胞衰老表型及相关的线粒体功能障碍呢?如果是,这是否是PTBP1下调导致相应表型的部分原因呢?为回答这些问题,研究团队进行了系列分子及细胞实验,发现:(1)特异性敲低NDUFV3的外显子包含转录本(NDUFV3_L)以模拟NDUFV3的外显子跳跃增加,可导致明显的细胞衰老表型及相关线粒体功能障碍特征;(2)在敲低PTBP1的基础上过表达NDUFV3_L(而非NDUFV3_S),可一定程度上挽救敲低PTBP1所诱导的细胞衰老表型;(3)过表达NDUFV3_S(而非NDUFV3_L)也可一定程度上导致细胞衰老表型及相关的线粒体功能改变;(4)敲低NDUFV3基因总体表达水平亦可导致明显的细胞衰老表型及相关的线粒体功能障碍。由此表明:PTBP1低表达导致的NDUFV3外显子跳跃增加可以导致细胞衰老表型及相关的线粒体功能障碍,而这是PTBP1低表达导致相应表型的部分原因;并且无论NDUFV3不同转录本的差异化使用,还是其总体表达水平的改变,皆对线粒体及细胞功能具有重要影响。
由于PTBP1可与NDUFV3的pre-mRNA第3个外显子区域结合而直接调控其外显子跳跃,预示着两者的调控关系可能具有广泛的普适性。有研究表明多数RNA结合蛋白在多种细胞衰老及组织器官衰老过程中表达下调,而在癌症中上调。因此研究团队推测:PTBP1表达水平与NDUFV3外显子跳跃水平的负相关性在多种细胞衰老体系及癌症中可能具有广泛的普适性的,并且两者还可能跟癌症病人的预后具有关联。通过对大量已发表的数据进行重分析,研究团队发现:(1)PTBP1的表达水平在多种人类细胞衰老、组织衰老过程表达下调,而在多种癌症中表达上调,并与癌症病人的良好预后负相关;(2)PTBP1表达水平与NDUFV3外显子跳跃水平的负相关关系不仅存在于HFF、IMR90等多个人类复制性细胞衰老体系中,亦存在于TCGA数据库收录的多种肿瘤样本中;(3)肿瘤组织NDUFV3的外显子跳跃水平(NDUFV3_S_TPM/NDUFV3_TPM)与合并统计的所有肿瘤及示例性的单种肿瘤(如HNSC,头颈部鳞状细胞癌)的病人良好预后存在明显正相关性。这些结果一方面表明了PTBP1与NDUFV3外显子跳跃剪接调控机制的普适性,另一方面亦暗示了功能关系的普适性。
总体来说,研究团队发现了PTBP1的下调表达介导了广泛的外显子跳跃事件,并可同时诱导细胞衰老和相关的线粒体功能变化;从机制上讲,研究团队揭示了PTBP1与线粒体复合体I亚基编码基因NDUFV3的pre-mRNA的第3个外显子区域相结合,并保护该外显子不被跳过,PTBP1的低表达则会促进NDUFV3的外显子跳跃;进一步的功能实验证实NDUFV3的外显子跳跃增加也可同时诱导细胞衰老和相关的线粒体功能变化,而这是PTBP1低表达导致相应表型的部分原因。进一步数据分析证据支持PTBP1表达水平与NDUFV3外显子跳跃之间的负相关性存在于其他细胞衰老模型和多种癌症中,提示这种剪接调节机制和功能调节关系具有广泛的普遍性,并可能具有潜在的临床应用价值。
复旦大学生命科学学院倪挺教授、粤港澳大湾区精准医学研究院顾正龙研究员为本文的共同通讯作者;粤港澳大湾区精准医学研究院博士后/复旦大学生命科学学院已毕业博士杨宇、复旦大学生命科学学院已毕业博士文海梅为本文的共同第一作者;同时复旦大学生命科学学院的李雨欣、曾鑫及魏刚博士也在本研究中做出了重要贡献。该研究得到了国家自然科学基金及国家重点研发计划的经费支持。
粤港澳大湾区精准医学研究院
GREATER BAY AREA INSTITUTE OF PRECISION MEDICINE
 公众号二维码
公众号二维码
版权所有© 粤港澳大湾区精准医学研究院 粤ICP备2021038868号 粤公网安备 44011502000710号
